Le travail de l'élève
Cette page présente les consignes données aux élèves, Vous pouvez également télécharger les fiches élèves au format PDF qui garantissent une conservation de la mise en forme.
| Téléchargement, fiche de travail des élèves |
Un indicateur coloré acide-base : le bleu de bromothymol (BBT)
A- Objectifs de réalisation
Dans le but de vérifier le modèle proposé :
-
Déterminer par spectrophotométrie les diagrammes de prédominance du BBT
-
Déterminer avec précision le pKa et la zone de virage du BBT
B- Partie préliminaire
-
Modèle du diagramme de prédominance d’un couple acide-base
Exemple du BBT :
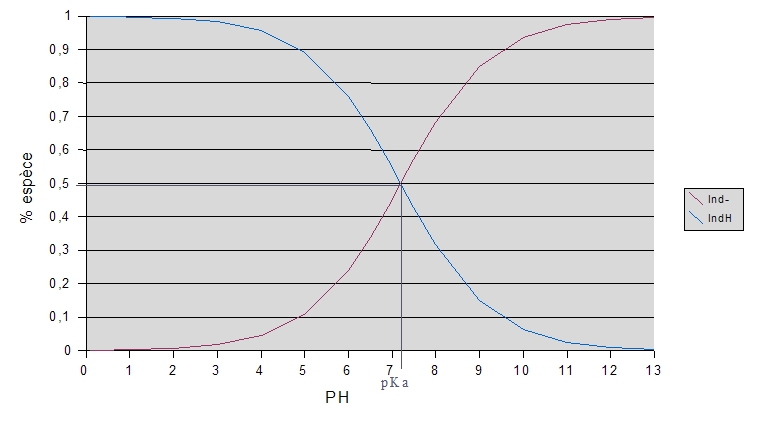 |
Diagramme de prédominance des espèces acides (IndH) et basique (Ind-) du BBT, en fonction du pH
-
A quoi sert la spectrophotométrie dans ce TP ?
Les espèces acides et basiques mesurées sont colorées. Ainsi, pour mesurer la quantité de ces espèces, nous pouvons utiliser la spectrophotométrie qui nous donnera une valeur d’absorbance.
C- Travail à réaliser
Ce travail est réalisé par groupes de 3 élèves
Important : Vous allez concevoir le protocole d’une expérience permettant d’atteindre les objectifs de réalisation proposés.
Afin que votre protocole soit complet, il est indispensable que vous notiez sur la feuille-réponse toutes les informations qui vous paraissent importantes.
-
Ecrivez le protocole de l’expérience avant de commencer la manipulation (sur feuille réponse). Cocher sur la feuille de réponse le matériel utilisé.
↳ Appelez l’enseignant (faire une photo du protocole)
-
Réalisez l’expérience correspondant à votre protocole.
Pensez à enregistrer le fichier de traitement de vos données.
Changer de couleur de stylo si vous apportez des changementss au protocole :
- Complétez le protocole si vous avez oublié de noter des éléments.
- Modifiez le protocole si vous pensez avoir fait des erreurs.
↳ Appelez l’enseignant
Répondez aux questions de la feuille-réponse.
D- Aides techniques
Protocole de BRITTON-ROBINSON.
Vous disposez d’une solution dite de BRITTON-ROBINSON (BR) constituée d’un mélange de plusieurs acides et dont le pH varie régulièrement par addition de soude de concentration 0,10 mol.L-1. On peut admettre grossièrement que pour un volume initial de solution de BR égal à 20mL, le pH obéit à la loi simple : pH = 1,2 + V(soude ajouté).
Contraintes techniques
-
Vous disposez de tubes à essai de volume égal à 30 mL
-
Pour mesurer le pH, une électrode de mesure de pH est utilisée. Cette électrode ne supporte pas les pH inférieurs à 3 et supérieurs à 11.
-
Pour mesurer le pH directement dans un tube à essai, il est nécessaire de plonger l’électrode de mesure dans un minimum de 10 mL de solution.
-
Dans vos solutions, vous ajouterez une quantité fixe de BBT. Pour être dans la bonne gamme d’utilisation du spectrophotomètre, le rapport du volume de BBT sur le volume total de solution devra être proche de 1/10.
-
Pour « faire le blanc » du spectrophotomètre, il serait trop long d’utiliser la solution de Britton-Robinson correspondant à chaque pH, vous pourrez vous contenter d’utiliser de l’eau.
Feuille réponse
Date :……………… Noms :……………………………………Numéro du groupe :……… Classe :……………………
Vous devrez rendre cette feuille réponse
-
Détaillez votre protocole d’expérience
Noms :………………………………………………… Numéro du groupe :………
-
Donnez la valeur du pKa trouvé et joignez le diagramme imprimé
..............................................................................................................
Noms :…………………………………………………… Numéro du groupe :………
-
Questions
Question 1 : liste du matériel
Surlignez ce dont vous avez besoin au fur et à mesure de la conception votre protocole.
|
tubes de 30 mL |
pH-mètre + électrode |
|
portoir pour tubes |
solutions tampons pour pH-mètre |
|
burette |
éprouvettes de ҇ 10 ҇ 20 mL |
|
pipettes jaugées de ҇ 2 ҇ 5 ҇ 10 ҇ 20 mL |
colorimètres |
|
pipettes graduées de 5 mL |
cuve pour colorimètre |
|
propipettes |
bécher |
|
fioles jaugés |
pissettes d'eau distillée |
|
.................... |
.................... |
|
................... |
.................... |
Question 2 : pourquoi faut-il mettre une quantité identique de BBT dans chaque solution ?
Question 3 : est-il possible de déterminer le pKa avec une seule des deux courbes obtenues à ce TP ?









